КРИСТАЛЛИЗАЦИЯ, утворення кристалів з розплавів, розчинів, газової фази або плазми, а також з аморфних речовин або кристалів іншої структури. У процесі кристалізації атоми, молекули або іони речовини шикуються в кристалічну решітку. Кристалізація є нерівноважних фазових переходом 1-го роду. Умови рівноваги кристала з середовищем (розплавом, паром, розчином та ін.) Визначаються як фазовий рівновагу агрегатних станів речовини при фазових переходах 1-го роду: рівність температури, тиску і хімічного потенціалу. Необхідна умова зростання кристала - відхилення від рівноваги, яке визначається переохолодженням (відмінністю температури від рівноважної) і пересиченням (відмінністю тиску або концентрації від рівноважних значень). Термодинамічна рушійна сила фазового переходу тим вище, чим більше відхилення від рівноваги. Перехід речовини в кристалічну фазу супроводжується виділенням прихованої теплоти кристалізації, і при неповному відвід цієї теплоти можливе зменшення відхилення від рівноваги і уповільнення процесу. Як фазовий перехід 1-го роду кристалізації супроводжується стрибком питомої обсягу по відношенню до вихідної фазі, і це може призводити до зміни тиску в кристалізується системі. Таким чином, кристалізація - це складний процес тепломасопереносу, який управляється термодинамическими і кінетичними факторами. Багато з них важко контролювати. Рівень чистоти, температура і концентрація компонентів в безпосередній близькості до фазової кордоні, перемішування, теплообмін можуть бути головними факторами, що визначають розмір, число і форму виникають кристалів.
Реклама
Центри кристалізації. Процес кристалізації складається з двох стадій: зародження центрів кристалізації і зростання кристалів. Початкова стадія - зародження центрів кристалізації - являє собою утворення кластерів з характерною для кристала впорядкованістю. Але іноді їх структура може відрізнятися від структури сталого макроскопічного кристала. Утворення таких кластерів в чистих рідинах або газах відбувається нижче температури плавлення масивного кристала в результаті випадкових зіткнень при тепловому русі атомів або молекул. При температурах нижче рівноважної об'єднання часток в кристалічний кластер термодинамічно вигідно, але поява його нової поверхні вимагає витрати енергії, що є що перешкоджає фактором при зародженні центрів кристалізації. Чим менше кластер, тим більша частка частинок становить його поверхню. Тому при малих розмірах більшість кластерів розпадається внаслідок флуктуацій коливальної енергії частинок. З ростом кластера частка поверхневої енергії зменшується по відношенню до об'ємної енергії об'єднання часток, що підвищує стійкість кластера. При заданому пересиченні існує критичний розмір, при перевищенні якого кластери здатні до подальшого зростання і стають центрами кристалізації.
Чисельної характеристикою інтенсивності зародження центрів кристалізації є частота зародкоутворення (нуклеации) - число центрів, що виникають в одиницю часу в одиниці об'єму середовища. Існуюча теорія пояснює температурну залежність частоти нуклеации і пов'язує її з параметрами середовища, в якій йде утворення центрів кристалізації. Для рідин з малою в'язкістю, наприклад для більшості розплавлених металів, теорія передбачає великі переохолодження, при яких має спостерігатися спонтанне зародження центрів кристалізації. При подальшому збільшенні переохолодження частота нуклеації швидко зростає, досягаючи максимуму при температурі, приблизно дорівнює одній третині температури рівноваги кристала з розплавом. Швидкий спад частоти зародження центрів кристалізації при ще більш низьких температурах обумовлений уповільненням теплового руху і сильним зростанням в'язкості. Для більш в'язких рідин максимум частоти зрушать убік більш низьких переохолоджень і самі значення частоти значно нижче.
Оскільки багато параметрів теорії відомі з недостатньою для розрахунків точністю, важливу роль відіграють експериментальні дані. Наближення до ідеальних умов досягається використанням в дослідах малих крапель рідин діаметром від декількох мікрометрів до нанометрів. При спонтанне зародження потрібні великі відхилення від рівноваги, а центри кристалізації характеризуються критичним розміром близько одного нанометра. Наприклад, для розплавів чистих металів спостерігається в дослідах температура спонтанного зародження центрів кристалізації становить 30-50% від температури плавлення. Багато силікатні розплави при охолодженні взагалі тверднуть без кристалізації, утворюючи скла. Експериментально показано, що в вузьких рідинах процес зародження центрів кристалізації нестационарен. Це означає, що характерна для заданого відхилення від рівноваги частота зародження центрів кристалізації з'являється тільки після закінчення часу запізнювання, яке може бути досить великим, яке можна порівняти або навіть перевищує час охолодження зразка. Металеві розплави характеризуються значно меншою в'язкістю, і придушення спонтанного зародження центрів кристалізації для деяких сплавів можливо лише при дуже швидкому охолодженні (зі швидкістю понад 106 К / с). Це лежить в основі технології отримання аморфних металів. Стабільність аморфного стану забезпечується сильним уповільненням обміну атомами між кристалом і середовищем при низьких температурах. Спостерігати кристалізацію отриманого таким чином аморфного стану можна при нагріванні, збільшуючи інтенсивність теплового руху, а виділяється при цьому прихована теплота фазового переходу може істотно інтенсифікувати процес, додатково підвищуючи температуру. Для деяких речовин (германій, кремній, аморфний лід) спостерігається вибухова кристалізація аморфного стану.
 У забруднених середовищах центри кристалізації виникають на сторонніх кристалічних частинках при набагато менших відхиленнях від рівноваги. Частота зародження центрів кристалізації в таких випадках залежить також від матеріалу стінок посудини, дії випромінювань. Зародкові кристали на добре змочують орієнтує поверхні мають приблизно куполоподібну форму, витратна частка поверхневої енергії у них менше в порівнянні з об'ємним виграшем при агрегування частинок в такій кристалик. Тому таке гетерогенное зародження центрів кристалізації відбувається при менших переохолодженнях. Контрольоване гетерогенное зародження центрів кристалізації використовується, наприклад, при епітаксиальні отриманні монокристалічних плівок. При вирощуванні на затравочного центрі кристалізації великих досконалих монокристалів, що містять мінімально можливу кількість дефектів, необхідно уникати появи спонтанних зародків. Для цього використовують невелике відхилення від умов рівноваги. У металургії при отриманні кристалічних матеріалів прагнуть отримати максимальну кількість центрів кристалізації, для чого створюють глибоке переохолодження розплавів.
У забруднених середовищах центри кристалізації виникають на сторонніх кристалічних частинках при набагато менших відхиленнях від рівноваги. Частота зародження центрів кристалізації в таких випадках залежить також від матеріалу стінок посудини, дії випромінювань. Зародкові кристали на добре змочують орієнтує поверхні мають приблизно куполоподібну форму, витратна частка поверхневої енергії у них менше в порівнянні з об'ємним виграшем при агрегування частинок в такій кристалик. Тому таке гетерогенное зародження центрів кристалізації відбувається при менших переохолодженнях. Контрольоване гетерогенное зародження центрів кристалізації використовується, наприклад, при епітаксиальні отриманні монокристалічних плівок. При вирощуванні на затравочного центрі кристалізації великих досконалих монокристалів, що містять мінімально можливу кількість дефектів, необхідно уникати появи спонтанних зародків. Для цього використовують невелике відхилення від умов рівноваги. У металургії при отриманні кристалічних матеріалів прагнуть отримати максимальну кількість центрів кристалізації, для чого створюють глибоке переохолодження розплавів.
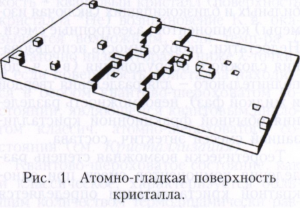
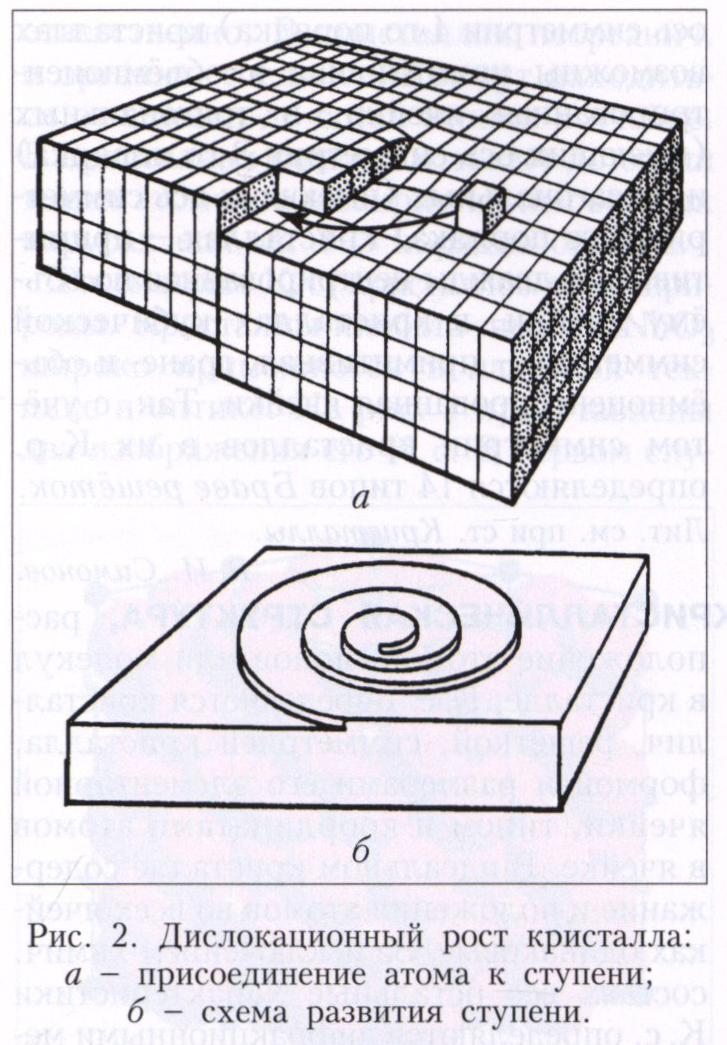 Механізми росту кристалів. Залежно від того, якою є поверхню кристала в атомному масштабі - гладкою або шорсткою, розрізняють два механізми росту кристалів: пошарове і нормальний. Атомно-гладких поверхнях зазвичай відповідають найбільш розвинені грані з простими кристалографічними індексами. Вони містять порівняно мало дефектів: вакансій і адсорбованих атомів. Краї незавершених атомних площин утворюють ступені (рис. 1), які, в свою чергу, мають невелике число зламів. елементарний акт росту кристалу складається в приєднанні нової частинки до зламу і не змінює поверхневу енергію. Послідовне приєднання частинок до зламу призводить до його руху вздовж ступені, а ступені по поверхні - таке зростання називається пошаровим. Щільність ступенів при пошаровому зростанні залежить від механізму їх генерації. Сходи можуть виникати в результаті освіти і зростання двовимірних зародків. Процес утворення двовимірних зародків, здатних до подальшого зростання на атомно-гладкій поверхні, має деяку аналогію з утворенням центрів кристалізації в рідини. двовимірний зародок також має критичний розмір, починаючи з якого він здатний до подальшого зростання. При агрегування двовимірного зародка перешкоджає фактором його розвитку при малих розмірах є витрата роботи на лінійну енергію його периметра. Але з ростом розміру частка лінійної енергії периметра стає все менше, і, починаючи з деякого критичного розміру, двовимірний зародок стає центром зростання новому щаблі. Частота освіти двовимірних зародків дуже мала при малих відхиленнях від рівноваги, відповідно мала і швидкість росту, обумовлена двовимірним зародкоутворення. Помітні швидкості росту при такому механізмі освіти ступенів починаються при відчутному переохолодженні і дуже сильно (експоненціально) зростають при його збільшенні. Інший механізм генерації ступенів пов'язаний з гвинтовими дислокаціями. Якщо кристал містить гвинтову дислокацію, то його зростання відбувається шляхом приєднання атомів до торця ступені, що закінчується на дислокації (рис. 2, а). При зростанні на гвинтовий дислокації щабель набуває спіральну форму (рис. 2, б), а помітна швидкість росту збільшується з переохолодженням за квадратичним законом і спостерігається вже при малих відхиленнях від рівноваги.
Механізми росту кристалів. Залежно від того, якою є поверхню кристала в атомному масштабі - гладкою або шорсткою, розрізняють два механізми росту кристалів: пошарове і нормальний. Атомно-гладких поверхнях зазвичай відповідають найбільш розвинені грані з простими кристалографічними індексами. Вони містять порівняно мало дефектів: вакансій і адсорбованих атомів. Краї незавершених атомних площин утворюють ступені (рис. 1), які, в свою чергу, мають невелике число зламів. елементарний акт росту кристалу складається в приєднанні нової частинки до зламу і не змінює поверхневу енергію. Послідовне приєднання частинок до зламу призводить до його руху вздовж ступені, а ступені по поверхні - таке зростання називається пошаровим. Щільність ступенів при пошаровому зростанні залежить від механізму їх генерації. Сходи можуть виникати в результаті освіти і зростання двовимірних зародків. Процес утворення двовимірних зародків, здатних до подальшого зростання на атомно-гладкій поверхні, має деяку аналогію з утворенням центрів кристалізації в рідини. двовимірний зародок також має критичний розмір, починаючи з якого він здатний до подальшого зростання. При агрегування двовимірного зародка перешкоджає фактором його розвитку при малих розмірах є витрата роботи на лінійну енергію його периметра. Але з ростом розміру частка лінійної енергії периметра стає все менше, і, починаючи з деякого критичного розміру, двовимірний зародок стає центром зростання новому щаблі. Частота освіти двовимірних зародків дуже мала при малих відхиленнях від рівноваги, відповідно мала і швидкість росту, обумовлена двовимірним зародкоутворення. Помітні швидкості росту при такому механізмі освіти ступенів починаються при відчутному переохолодженні і дуже сильно (експоненціально) зростають при його збільшенні. Інший механізм генерації ступенів пов'язаний з гвинтовими дислокаціями. Якщо кристал містить гвинтову дислокацію, то його зростання відбувається шляхом приєднання атомів до торця ступені, що закінчується на дислокації (рис. 2, а). При зростанні на гвинтовий дислокації щабель набуває спіральну форму (рис. 2, б), а помітна швидкість росту збільшується з переохолодженням за квадратичним законом і спостерігається вже при малих відхиленнях від рівноваги.
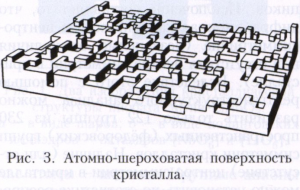 На атомно-шорсткуватих поверхнях (рис. 3) щільність зламів велика і приєднання нових частинок до кристалу відбувається практично в будь-якій точці його поверхні. Таке зростання називається нормальним. Його швидкість лінійно збільшується з переохолодженням. Теорія росту кристалу пов'язує щільність упаковки поверхні кристала з енергією зв'язку між частинками поверхні кристала і теплотою кристалізації. Вважається, що якщо енергія зв'язку досить велика, все щільноупакована межі - гладкі. Це характерно для кристалів, що ростуть з пара. Теплота кристалізації розплавів, як правило, значно нижче, ніж теплота кристалізації з пара, тому і енергія зв'язку частинок в кристалі в порівнянні з розплавом менше, ніж в порівнянні з парою. У зв'язку з цим поверхню кристала, що росте з розплаву, зазвичай шорстка, що визначає нормальний ріст і формування округлених граней. Перехід від шорсткості до огранений можливий при зміні концентрації в двокомпонентних системах при зростанні кристала з розчину. У кристалах Німеччина і кремнію, що ростуть з розплаву, можна спостерігати співіснування плоских і округлених граней.
На атомно-шорсткуватих поверхнях (рис. 3) щільність зламів велика і приєднання нових частинок до кристалу відбувається практично в будь-якій точці його поверхні. Таке зростання називається нормальним. Його швидкість лінійно збільшується з переохолодженням. Теорія росту кристалу пов'язує щільність упаковки поверхні кристала з енергією зв'язку між частинками поверхні кристала і теплотою кристалізації. Вважається, що якщо енергія зв'язку досить велика, все щільноупакована межі - гладкі. Це характерно для кристалів, що ростуть з пара. Теплота кристалізації розплавів, як правило, значно нижче, ніж теплота кристалізації з пара, тому і енергія зв'язку частинок в кристалі в порівнянні з розплавом менше, ніж в порівнянні з парою. У зв'язку з цим поверхню кристала, що росте з розплаву, зазвичай шорстка, що визначає нормальний ріст і формування округлених граней. Перехід від шорсткості до огранений можливий при зміні концентрації в двокомпонентних системах при зростанні кристала з розчину. У кристалах Німеччина і кремнію, що ростуть з розплаву, можна спостерігати співіснування плоских і округлених граней.
 Форми росту кристалів визначаються анізотропією їх властивостей і умовами тепломассопереноса в процесі кристалізації. Кристали з шорсткими поверхнями мають зазвичай округлу форму. При вирощуванні таких кристалів через великій швидкості поверхневих процесів переохолодження на кордоні з розплавом мало і зростаюча поверхню повторює форму ізотерми температурного поля в системі при температурі рівноваги. Атомно-гладкі поверхні проявляються у вигляді граней. Рівноважна форма кристалічного багатогранника така, що відстань від центру до кожної грані пропорційно величині її поверхневої енергії. Рівноважна форма є і стаціонарною формою росту, але в реальному процесі росту вона може бути сильно спотворена через нестійкість поверхні зростання при кінцевому (а не нескінченно малому) переохолодженні, вплив домішок.
Форми росту кристалів визначаються анізотропією їх властивостей і умовами тепломассопереноса в процесі кристалізації. Кристали з шорсткими поверхнями мають зазвичай округлу форму. При вирощуванні таких кристалів через великій швидкості поверхневих процесів переохолодження на кордоні з розплавом мало і зростаюча поверхню повторює форму ізотерми температурного поля в системі при температурі рівноваги. Атомно-гладкі поверхні проявляються у вигляді граней. Рівноважна форма кристалічного багатогранника така, що відстань від центру до кожної грані пропорційно величині її поверхневої енергії. Рівноважна форма є і стаціонарною формою росту, але в реальному процесі росту вона може бути сильно спотворена через нестійкість поверхні зростання при кінцевому (а не нескінченно малому) переохолодженні, вплив домішок.
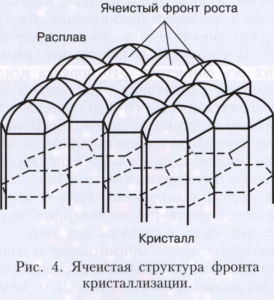
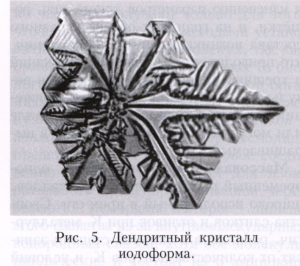 Якщо розплав сильно переохолоджених і температура в розплаві зменшується в міру віддалення від фронту зростання, то зростання нестійкий: випадково що виник на поверхні кристала виступ потрапляє в область більшого переохолодження, і швидкість його росту збільшується. Така нестійкість для плоского фронту кристалізації веде до утворення полосчатой або пористої структури кристала (рис. 4). При зростанні маленького кристала ця нестійкість проявляється, починаючи з деякого розміру кристала. На ньому розвиваються виступи, і він набуває кісткову або дендритну форму, яка характеризується появою вторинних гілок після досягнення первинним виступом критичної довжини (рис. 5). Зростання великих огранованих кристалів з нерухомого розчину може бути також нестійкий. Пересичення в цьому випадку вище у вершин і ребер кристала і менше в центральних частинах межі. Тому вершини стають провідними джерелами зростання шарів. При великій різниці пересичень на вершинах і в центрах граней вершини обганяють центри граней, і виникає скелетна форма кристала (рис. 6). При заданій температурі в двухкомпонентной системі рівновага може існувати при різних складах кристала і розплаву. При зростанні кристала один з компонентів накопичується перед фронтом, викликаючи концентраційне переохолодження, і це часто призводить до нестійкості фронту зростання.
Якщо розплав сильно переохолоджених і температура в розплаві зменшується в міру віддалення від фронту зростання, то зростання нестійкий: випадково що виник на поверхні кристала виступ потрапляє в область більшого переохолодження, і швидкість його росту збільшується. Така нестійкість для плоского фронту кристалізації веде до утворення полосчатой або пористої структури кристала (рис. 4). При зростанні маленького кристала ця нестійкість проявляється, починаючи з деякого розміру кристала. На ньому розвиваються виступи, і він набуває кісткову або дендритну форму, яка характеризується появою вторинних гілок після досягнення первинним виступом критичної довжини (рис. 5). Зростання великих огранованих кристалів з нерухомого розчину може бути також нестійкий. Пересичення в цьому випадку вище у вершин і ребер кристала і менше в центральних частинах межі. Тому вершини стають провідними джерелами зростання шарів. При великій різниці пересичень на вершинах і в центрах граней вершини обганяють центри граней, і виникає скелетна форма кристала (рис. 6). При заданій температурі в двухкомпонентной системі рівновага може існувати при різних складах кристала і розплаву. При зростанні кристала один з компонентів накопичується перед фронтом, викликаючи концентраційне переохолодження, і це часто призводить до нестійкості фронту зростання.
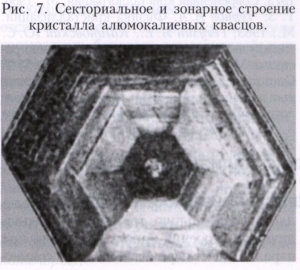
 Різні грані кристала при зростанні захоплюють різні кількості домішок, що містяться в середовищі. Так виникає його секторіальноє будова. Якщо кристал погано захоплює домішку, відбувається її накопичення перед фронтом зростання. Періодичний захоплення цього прикордонного шару зростаючим кристалом призводить до формування занурені структури (рис. 7). Захоплення домішок призводить до зміни параметрів кристалічної решітки, і на кордонах областей різного складу виникає внутрішня напруга, що призводить до утворення дислокацій і тріщин. Дислокації виникають в результаті релаксації пружних напружень в нерівномірно нагрітому кристалі або можуть переходити з затравки в вирощується кристал.
Різні грані кристала при зростанні захоплюють різні кількості домішок, що містяться в середовищі. Так виникає його секторіальноє будова. Якщо кристал погано захоплює домішку, відбувається її накопичення перед фронтом зростання. Періодичний захоплення цього прикордонного шару зростаючим кристалом призводить до формування занурені структури (рис. 7). Захоплення домішок призводить до зміни параметрів кристалічної решітки, і на кордонах областей різного складу виникає внутрішня напруга, що призводить до утворення дислокацій і тріщин. Дислокації виникають в результаті релаксації пружних напружень в нерівномірно нагрітому кристалі або можуть переходити з затравки в вирощується кристал.
 Масова кристалізація - одночасне зростання безлічі кристалів, широко використовуваний в промисловості. Властивості злитків і виливків при кристалізації металургійних розплавів в сильному ступені залежать від кількості центрів кристалізації і умов їх зростання. При затвердінні відливок металів центри кристалізації з'являються спочатку на охолоджуваних стінках виливниці, куди заливають розплавлений метал. З хаотично орієнтованих кристалів виживають ті, які ростуть перпендикулярно стінці. Вони формують столбчатую зону поблизу стінки. Конвекційні потоки в розплаві можуть обламувати гілки дендритів, поставляючи в розплав вторинні центри кристалізації. Масова кристалізація в розчинах починається на гетерогенних центрах кристалізації або на спеціально введених затравочних кристалах. Зіткнення цих кристаликів між собою і зі стінками посудини в перемішувати розчині дають початок вторинним центрам кристалізації. Для створення додаткових центрів кристалізації використовують УЗ-дроблення зростаючих кристалів або добавки поверхнево-активних речовин. Масова кристалізація використовується також для очищення речовин від домішок.
Масова кристалізація - одночасне зростання безлічі кристалів, широко використовуваний в промисловості. Властивості злитків і виливків при кристалізації металургійних розплавів в сильному ступені залежать від кількості центрів кристалізації і умов їх зростання. При затвердінні відливок металів центри кристалізації з'являються спочатку на охолоджуваних стінках виливниці, куди заливають розплавлений метал. З хаотично орієнтованих кристалів виживають ті, які ростуть перпендикулярно стінці. Вони формують столбчатую зону поблизу стінки. Конвекційні потоки в розплаві можуть обламувати гілки дендритів, поставляючи в розплав вторинні центри кристалізації. Масова кристалізація в розчинах починається на гетерогенних центрах кристалізації або на спеціально введених затравочних кристалах. Зіткнення цих кристаликів між собою і зі стінками посудини в перемішувати розчині дають початок вторинним центрам кристалізації. Для створення додаткових центрів кристалізації використовують УЗ-дроблення зростаючих кристалів або добавки поверхнево-активних речовин. Масова кристалізація використовується також для очищення речовин від домішок.
Застосування кристалізації. У природі кристалізація приводить до утворення мінералів, льоду, грає важливу роль в багатьох біологічних процесах. Кристалізація відбувається також при деяких хімічних реакціях, в процесі електролізу. Вона лежить в основі багатьох технологічних процесів: в металургії, при отриманні матеріалів для електроніки, оптики. Шляхом кристалізації отримують масивні монокристали і тонкі плівки. Кристалізація широко використовується в хімічній, харчовій, медичній промисловості: в технології очищення речовин, при виробництві солі, цукру, ліків.
Літ .: Шубніков А. В. Освіта кристалів. М .; Л., 1947; Леммлейн Г. Г. Морфологія і генезис кристалів. М., 1973; Лодіз Р. А., Паркер Р. Л. Зростання монокристалів. М., 1974; Проблеми сучасної кристалографії. М., 1975; Сучасна кристалографія. М., 1980. Т. 3; Чернов А. А. Фізика кристалізації. М., 1983; Гегузін Я. Е., Кагановський Ю. С. Дифузійні процеси на поверхні кристала. М., 1984; Скрипів В. П., Коверда В. П. Спонтанна кристалізація переохолоджених рідин. М., 1984; Проблеми кристалографії. М., 1987; Чупрунов Е. В., Хохлов А. Ф., Тадея М. А. Кристаллография. М., 2000..
В. П. Коверда.
